Oggi, dopo aver udito leggende e miti narrare di misteriosi di zinchi e oscure corrosioni, abbiamo deciso di intraprendere un viaggio, per portare luce in uno dei meandri più tenebrosi della nautica: le correnti galvaniche. Il seguente articolo non vuole essere in alcun modo una tesi di laurea ma solo piccolo vademecum per coloro i quali vogliono capire meglio questo fenomeno, in particolare tratteremo delle celle galvaniche, una delle principali cause delle corrosioni galvaniche e di uno dei principali sistemi di difesa: gli anodi sacrificali.
Le tre cause del male
Partiamo subito cercando di semplificare e dividere le tre principali cause che possono portare a corrosioni galvaniche:
- Celle Galvaniche
- Correnti di Terra
- Dispersioni
La pila portatrice di luce
In queste tenebre dobbiamo per forza affidarci a una pila, magari quella di Volta, per far meglio luce e capire cosa c’è sotto a queste misteriose correnti. Alessandro Volta nel 1796 scoprì che due metalli messi a contatto tra loro o connessi da un liquido conduttivo, generano una differenza di tensione, e sfruttando questo fenomeno inventò la prima pila.
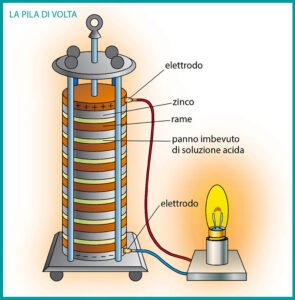
La causa principale che sta al di sotto di questo fenomeno fisico è una proprietà dei metalli detta “lavoro di estrazione“, essa definisce l’energia minima necessaria per estrarre un elettrone da un metallo. In poche parole, ogni metallo è più o meno propenso a lasciare andare gli elettroni e questo comporta che, tra due metalli a contatto, aventi differenti lavori di estrazione, si creerà un flusso di elettroni dal metallo con più debole lavoro di estrazione (anodo, detto anche meno nobile) a quello con valore più alto (catodo, detto anche più nobile).
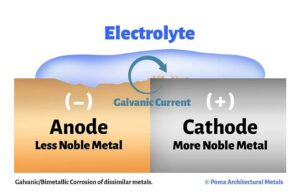
In questo sistema, detto anche cella galvanica, le correnti in gioco causano l’ossidazione del metallo meno nobile.
L’entità della corrosione è direttamente correlata ai seguenti fattori:
- differenza di potenziale dei due metalli;
- quantità di ossigeno;
- rapporto di superficie tra anodo e catodo (più è piccolo l’elemento meno nobile maggiore è l’entità della corrosione);
- salinità dell’acqua;
- temperatura dell’acqua.
Mala herba non interit
E’ quindi ormai chiaro che in una imbarcazione, immersa nell’acqua salata e composta da diversi metalli, non è possibile eliminare alla sorgente questo problema ma solo tentare di arginarlo, vediamo meglio come:
- evitare di utilizzare metalli con grandi differenze di potenziale elettrico;
- isolare gli elementi con paste dielettriche o giunti dielettrici;
- sfruttare passivazione del metallo, verniciature protettive o cromature;
- utilizzare sistemi di protezione passiva: i nostri mitici “zinchi“;
- utilizzare sistemi di protezione attiva: sistemi a corrente impressa;
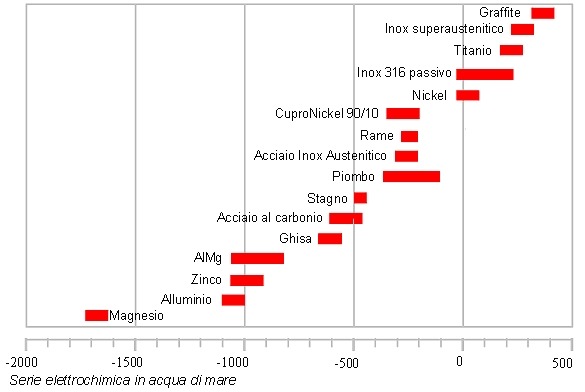
Gli anodi sacrificali di zinco, alluminio e magnesio
Gli anodi sacrificali o più comunemente detti zinchi permettono di proteggere i diversi metalli vulnerabili di una imbarcazione dalla maggior parte dei danni causati da corrosione galvanica, essi, aggiunti in punti specifici dello scafo, sono il materiale meno nobile facente parte della cella galvanica, sono loro quindi a prendersi carico dell’ossidazione salvaguardando tutta la catena di metalli più nobili a monte. Gli anodi possono essere fatti di diverse leghe, nelle acque salate, solitamente si utilizza lo zinco o l’alluminio, mentre nelle acque dolci, si preferisce metalli più attivi come il magnesio.
Il magnesio consente un ottima protezione dal punto di vista galvanico, ma a causa della sua attività cosi alta tende a ossidarsi troppo presto, è per questo motivo che in acque salmastre e salate che sono più conduttive non si utilizza.
Lo zinco, invece, risulta ottimo nelle acque ricche di sali, ma con il passare del tempo, a causa delle norme ecologiche sempre più severe tenderà a essere sostituito da altre leghe che non rilascino cadmio durante il processo di corrosione, a tal proposito, quelle a base di alluminio sono un ottima alternativa.
Caratteristica interessante dell’anodo di alluminio è l’elevata capacità elettrica nominale, che a pari massa dello zinco, è tripla. Questo vantaggio fa si che l’anodo di alluminio si utilizzi in grosse strutture dove se si desiderasse usare lo zinco bisognerebbe installare enormi quantità di materiale complicando il processo di installazione, sostituzione e logistica del trasporto. Naturalmente, per poter sostituire i propri anodi di zinco con anodi di alluminio bisogna sempre contattare un esperto del settore, che attraverso appositi software, è in grado di valutare forma, dimensione e peso del nuovo anodo.
La virtù sta nel mezzo: sottoprotezione e sovraprotezione
Spesso ci capita di essere chiamati per la verifica del corretto funzionamento degli anodi sacrificali, in tali occasioni, attraverso l’utilizzo di un apposito strumento, misuriamo la differenza di tensione tra il mare e le varie parti metalliche dell’imbarcazione interessata al fine di controllare se i valori sono all’interno di opportuni range, poiché anche una troppo alta protezione può sfociare in spiacevoli inconvenienti come fenomeni di esfoliazione della vernice o peggio ancora corrosione da pitting. Tali fenomeni si possono verificare anche nel caso in cui l’anodo sacrificale non venga installato correttamente, esso infatti deve essere collegato alla linea di bonding solo attraverso il bullone mentre la sua base deve sempre essere isolata dallo scafo per mezzo di un apposito strato di coating o un materiale isolante.
Al fine di mantenere la corretta protezione è sempre necessario ricordarsi di sostituire correttamente gli anodi e nel caso in cui si usino di alluminio è sempre bene installarli all’ultimo e grattarli pochi attimi prima dell’entrata in mare così da eliminare lo strato di allumina che si genera a contatto con l’aria e che ne impedisce il corretto funzionamento in mare, un altro fattore importante è il corretto isolamento dello scafo per mezzo della vernice dato che più il suo spessore diminuisce più il sistema di protezione passiva viene sfruttato.